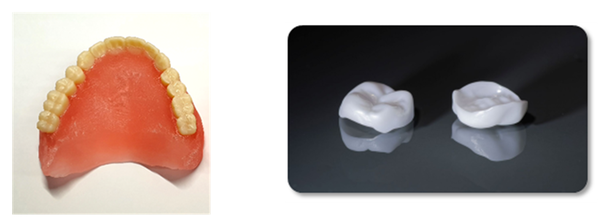
 ▲ 3D프린팅으로 제작된 의치상용레진(左)과 심미치관재료
▲ 3D프린팅으로 제작된 의치상용레진(左)과 심미치관재료3D프린팅 기술로 제작된 치과용 의료기기의 허가·심사를 위한 가이드라인이 발간돼 제품 활성화에 도움이 될 전망이다.
식품의약품안전처(처장 김강립)는 액상 고분자, 세라믹 분말 등의 신소재를 이용한 환자 맞춤형 3D프린팅 치과용 의료기기를 위한 허가·심사 민원인안내서(가이드라인) 2건을 발간했다고 밝혔다.
구체적으로는 △3D프린팅 기술을 이용해 액상고분자로 제작하는 ‘틀니의 잇몸 부분’을 만드는 재료인 ‘의치상용레진’ 의료기기에 관한 허가·심사 가이드라인 △3D프린팅 기술을 이용한 크라운 등 치아의 일부 또는 전체를 대체하는 치과보철물인 심미치관재료(의료기기)의 소재로 세라믹 분말을 사용하는 경우 의료기기 허가를 위한 허가·심사 가이드라인 등이다.
주요 내용은 △허가·인증·신고 절차 및 항목 △3D프린팅 제조공정을 고려한 적층기술 등 기재사항 △안전성·유효성 입증자료 요건 △성능평가 항목 및 시험방법 등을 담고 있다.
3D프린팅으로 제작된 치과용 의료기기를 사용하는 경우 의료진의 정밀하고 정확한 시술을 가능하게 하고 시술시간을 단축시킬 수 있고, 특히 환자에게는 시술 후 불편함을 줄일 수 있어 치과용 의료기기 관련 분야에서 3D프린팅 기술이 활발하게 활용되고 있다.
이번 가이드라인을 통해 다양한 신소재가 의료기기 분야에서 활용되면서, 3D프린팅으로 치과용 의료기기를 개발 중인 관련 업체의 제품화가 활발히 이뤄질 것으로 기대되고 있다.
식약처 관계자는 “앞으로도 4차 산업혁명 시대의 변화하는 환경에 발맞추어 새로운 기술에 대한 허가·심사방안을 선제적 마련하고, 혁신적인 의료기기의 제품화를 적극 지원해 나겠다”고 밝혔다.
한편 이번 가이드라인은 식약처 홈페이지내 법령/자료→법령정보→공무원지침서/민원인안내서)에서 확인할 수 있다.
