감염원 특성 및 부위 따라 ‘진단법’도 각양각색
코로나19엔 체외진단 분자기술·면역화학법 적용
PCR·유전자가위 등 다양 진단 키트 및 소재 활용중
■기술의 정의 및 분류
감염병 진단은 감염 부위와 병원체의 종류에 따라 다양한 검출방법을 사용하며, 질병 특이적 증상 및 CT, X-Ray 등 영상의학적 검사 등을 통해 의료진의 판단에 따라 결정된다. 감염병 진단은 크게 유전자 기반의 분자 검사(Molecular Test)와 면역진단 기반의 혈청학적(Serological Test) 검사로 나눌 수 있다.
분자 검사는 병원체(세균 및 바이러스)의 유전물질(DNA 및 RNA)을 중합효소 연쇄 반응(PCR; Polymerase Chain Reaction)을 통해 증폭하는 방법을 사용하며, 체외진단 방법 중 정확도가 가장 높은 진단기술이다.
혈청학적 검사는 병원체의 단백질 또는 인체 내 형성된 항체를 측정하는 방식으로 감염 여부를 판단하는 진단기술이다. 이는 분자진단처럼 타겟 유전자 수 증가를 위한 증폭 과정을 거치지 않으므로, 단시간에 판정이 가능한 신속 진단 키트 개발에 용이하지만 감염 초기에 극미량의 항원 및 항체가 존재하는 경우 진단 정확도가 떨어지는 단점이 있다.
이외에도 CT 및 X-Ray 등 영상의학적 진단을 활용하거나 검체에서 분리한 병원체를 배양하여 현미경으로 진단하는 방법 등 감염원의 특성 및 감염 부위에 따라 여러 가지 진단방법이 있으며, 검사 방법에 따라 다양한 진단 키트 및 진단 소재들이 사용되고 있다.
■기술의 원리
1) 분자진단법
분자진단기술은 병원체 핵산(DNA 및 RNA)을 검체(비인두 스왑, 객담, 침 등)에서 검출하여 진단하는 방법이다. 검체 내에 존재하는 병원체 핵산을 선택적으로 증폭하여 감염 여부를 판단한다. 환자 검체 채취, 유전자 추출, 유전자 증폭 및 결과분석까지 총 4∼6시간 정도 소요된다. 진단 정확도가 높아 코로나 19 표준 검사법으로 활용되고 있으며, 유전자 증폭 및 검사를 위한 고가의 분석 장비와 전문 검사인력이 필요하다.
① Real-time PCR(RT-PCR)
Real-time PCR 법은 현재 분자진단에 가장 많이 활용되고 있는 유전자 검출법이다. 검출 타겟 유전자, 프라이머(primer), 중합 효소(polymerase), dNTP(deoxynucleoside triphosphate) 등이 혼합된 용액을 준비하고, 40 oC∼90 oC의 온도를 반복적으로 인가하는 thermal cycle 과정을 거치게 되면, 연속적인 중합반응에 의해 유전자 수가 증가하는 원리를 이용한다.
검출 타겟 유전자 수가 증가함에 따라 반응하는 형광 분자의 신호 증가량을 실시간으로 측정하여 유전자 증폭량을 정량한다. 초기 타겟 유전자의 양, 증폭 cycle 수에 따라 증폭 곡선의 형성 특성이 달라진다. 감염병 진단의 경우, 타겟 병원체 유전자를 증폭할 수 있는 프라이머에 의해 검체 내 병원체 유전자가 증폭되는지 여부에 따라 의심 환자의 감염 여부를 판단한다.
② Digital PCR
유전자 수를 증폭하는 개념은 RT-PCR과 동일하지만, PCR 반응을 수만 개의 미세 방울로 쪼개어 진행한 후 증폭된 유전자 신호를 계수하는 방법을 활용한다. 미세 방울 내 타겟 유전자가 증폭된 경우와 증폭되지 않은 경우 2가지를 디지털 신호처럼 분석할 수 있어 디지털 PCR이라는 이름이 붙여졌다. 기존 RT-PCR에 비해 1,000배 이상 높은 민감도를 나타내고, 혼합물 상태에서 타겟 유전자 분석이 용이하며, 표준 곡선 생성이 필요 없다는 장점이 있다.
③ 유전자 등온증폭법(Isothermal Amplification)
등온증폭법은 일정한 온도에서 유전자 수를 증폭하는 방법으로, 기존 PCR법의 온도 구배가 필요하지 않아 반응시간이 짧은 장점이 있다. 온도 변화에 따른 유전자 손상 가능성이 줄어들어 증폭 효율이 높고, 고가의 장비가 필요하지 않아 현장 적용성도 우수하다. 하지만, 프라이머 디자인과 효소반응이 다소 복잡하고, 다중 진단법 개발이 추가적으로 필요하다는 단점이 남아있다.
④ 유전자 가위(Genetic Scissors)
유전자 가위 기술은 유전자의 특정 염기서열을 인식하여 원하는 대로 자르고 편집하는 기술을 의미한다. 특히, 크리스퍼(CRISPR)유전자 가위를 이용한 분자진단법은 차세대 분자진단 기술의 핵심기술로 활용될 것으로 전망된다. 검체에서 증폭된 타겟 유전자를 CRISPR-Cas 시스템이 인지하고, 형광 분자를 잘라내어 신호를 형성하게 하는 원리로 분자진단 기술에 활용된다. 등온증폭 기술법과 융합하여 초고감도, 신속 분자진단 기술로 개발하기 위해 활발히 연구되고 있다.
2) 면역화학진단법
면역화학진단법은 항원-항체반응을 통해 질병의 원인이 되는 특정 단백질(바이오마커)을 검출하는 방법으로, 측정 방식에 따라 항원검사(Antigen Test)와 항체검사(Antibody Test)로 구분할 수 있다.
① 효소결합면역흡착검사(Enzyme-linked Immunosorbent Assay; ELISA)
ELISA법은 검사의 타겟이 되는 항원이나 항체를 정성, 정량분석 할 수 있는 방법으로 가장 널리 사용되는 면역정량법이다. 감도가 우수하고, 다양한 검체(혈액, 혈청, 소변, 세포, 조직 등)에서 타겟을 검출할 수 있는 방법이다. ELISA의 방법으로는 Direct ELISA, Indirect ELISA, Sandwich ELISA, competitive ELISA가 있다.
Direct ELISA는 항원과 반응하는 1차 항체에 효소가 결합하여 반응물을 검출하는 방법이고, Indirect ELISA는 항원과 결합하는 1차 항체는 항원과 결합하고, 효소가 결합된 2차 항체가 1차 항체를 잡는 방식을 이용한다. Sandwich ELISA는 1차 항체가 플레이트에서 항원을 잡은 후, 또 다른 항체가 항원의 다른 인지 부분(Epitope)을 잡아 선택성을 높인 방법이다. 이후 효소 반응을 유도하여 생성된 신호를 검출한다.
Competitive ELISA는, 항체가 검체 내 존재하는 항원의 양에 따라 플레이트에 미리 코팅되어있는 항원과 경쟁적으로 반응하는 원리를 이용한다. 검체 내 항원 농도가 높을수록 생성 신호가 줄어드는 방법을 이용하여 감도가 높다. 효소 반응에 의해 생성되는 발색반응, 형광 신호 등을 이용하여 항원 정량에 이용한다. 분석 목적에 따라 활용되는 ELISA법이 다르며, 다소 숙련된 검사자가 필요하다는 단점이 있다.
② 신속 진단 키트
현장에서 검체 내 바이오마커의 존재 유무를 신속하게 판별하기 위해 측방유동(lateral flow) 면역센서를 활용하는 제품들이 많이 출시되고 있다. 임신 진단키트와 같은 원리로, 항원이 존재할 시 금 나노입자 표면에 고정된 항체가 측방으로 흐르면서 측정선에 위치한 항체에 의해 잡히면, 금 나노입자의 색이 나타나는 원리이다. 항원 항체 반응을 이용하기 때문에 최근 감염병 병원체와 관련된 바이오마커를 신속하게 검출할 수 있는 키트 형태로 개발되어 진단에 활용하고 있다.
항원검사(Antigen Test)는 검체 내 항원(병원체)이 진단키트에 탑재된 항체와 결합하여 생성되는 신호를 판별하여 감염 여부를 진단하는 검사법이다. 검체 중 항원이 존재하면 항원-항체 결합반응에 의해 항체에 부착되어 있는 발색물질이 활성화되어 육안으로 확인할 수 있다. 진단을 위해 특별한 장비가 필요없어 빠른 시간에 진단할 수 있지만, 분자진단법에 비해 정확도가 떨어지고, 발현 초기에 진단이 어렵다는 단점이 있다.
항체검사(Antibody Test)는 검사자의 체내에 형성된 항체를 진단키트에 있는 항원 또는 항체와 결
합시켜 감염 여부를 진단하는 검사법이다. 기본 개념은 항원검사법과 유사하지만 검체에 존재하는 항체가 항원으로 작용한다는 차이점이 있다.
예를 들어, 바이러스 감염시 형성되는 IgG 및 IgM 등의 항체와 결합하는 합성된 항체(안티 IgG 및 안티 IgM)를 진단 키트에 이용할 수 있다. 항원검사법과 동일하게 30분 이내에 검사가 가능하고, 체내에서 항체가 생성되어야 검출이 가능하기 때문에 감염 초기에는 사용이 어렵다는 단점이 있다.
피검자가 감염되었던 이력과 감염 후 항체 형성 진행 과정을 모니터링하는 데 적합한 기술이다. 분자진단 기술 대비 진단 정확도는 낮지만, 신속 진단이 가능하여 대규모 집단검사를 통한 고위험군 환자 선별(screening)에 적용될 수 있다.
③ 미생물배양법
박테리아의 경우 염색을 통해 현미경으로 관찰하여 그램 양성/음성을 판단할 수 있다. 검체 내 박테리아의 수가 적은 경우 플레이트에 배양하여 검사가 가능한 정도로 개체 수를 충분히 확보하기 위해 활용한다.
항생제 처방을 위해 박테리아의 종류를 확인하는 데 사용하며, 정확한 미생물 종 파악을 위해 추가적인 핵산검사를 실시한다. 항생제 감수성 시험에 중요한 방법으로 활용된다. 바이러스의 경우 숙주 세포에 감염하여 배양하고, 판별을 위해 핵산검사를 실시한다.
④ 코로나 19 진단 기술
코로나 19는 코로나바이러스의 일종인 SARS-CoV-2 감염에 의한 호흡기 증후군으로, 2019년 12월 중국에서 최초로 보고된 이후 현재까지 비말 접촉 및 공기를 통해 전파되는 것으로 알려져 있으며, 평균 4~7일의 잠복기를 거쳐 기침·호흡곤란·폐렴 등 다양한 호흡기 감염증이 나타나는 질병이다.
코로나 19 진단에는 체외진단기기를 사용한 분자진단기술 및 면역화학 진단기술이 주로 활용되고 있다. 현재, 코로나 19 확진에는 의심 환자의 비인두(鼻咽頭)에서 채취한 검체에서 유전자를 추출하고 RT-PCR 과정을 거쳐 최종 확진을 결정한다. 항체검사는 혈액 검체를 이용하여 코로나 19 바이러스에 대한 항체 형성을 검사하는 방법이다.
항체는 감염된 이후 생성되기 때문에, 검사 결과 양성이 판정되면 이전에 코로나 19에 감염된 적이 있다는 것을 뜻한다. 하지만 코로나 19 바이러스 항체 형성에 보통 1∼3주 정도 걸린다고 알려져 있으므로, 초기 감염 여부를 확인하기에는 어려운 방법이다. 향후 코로나 19 백신이 개발되면 항체 형성 판단에 활용될 수 있다.
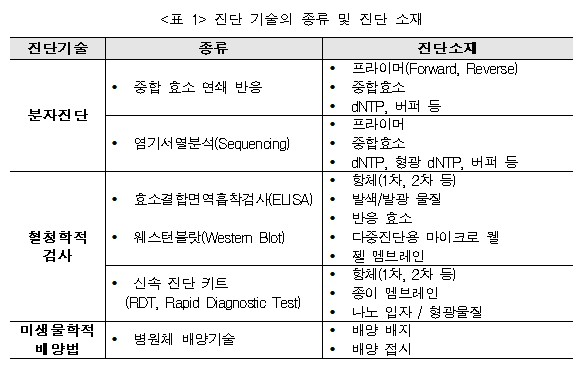 ▲ ▲<표 1> 진단 기술의 종류 및 진단 소재
▲ ▲<표 1> 진단 기술의 종류 및 진단 소재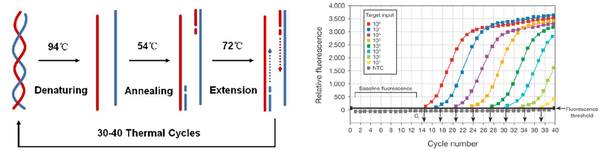 ▲ <그림 1> 유전자 증폭 과정 및 증폭 곡선
▲ <그림 1> 유전자 증폭 과정 및 증폭 곡선  ▲ <그림 2> Digital PCR원리
▲ <그림 2> Digital PCR원리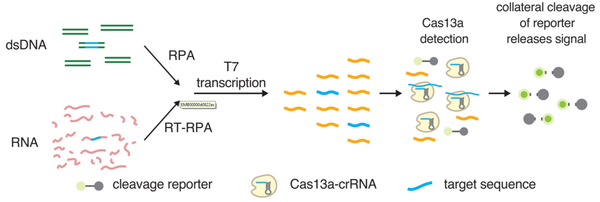 ▲ <그림 3> 유전자 가위를 이용한 분자진단법 원리
▲ <그림 3> 유전자 가위를 이용한 분자진단법 원리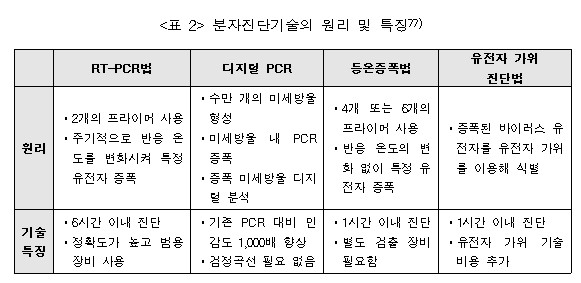 ▲ <표 2> 분자진단기술의 원리 및 특징
▲ <표 2> 분자진단기술의 원리 및 특징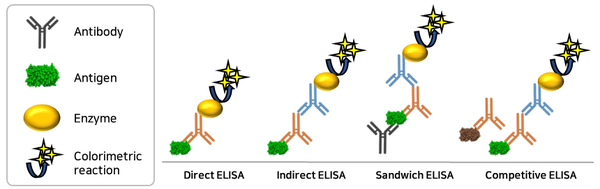 ▲ <그림 4> ELISA 방법 및 종류
▲ <그림 4> ELISA 방법 및 종류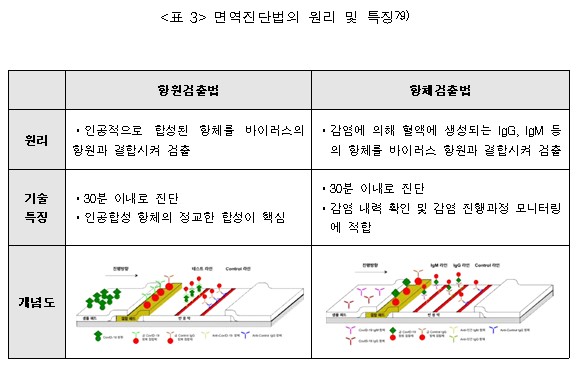 ▲ <표 3> 면역진단법의 원리 및 특징
▲ <표 3> 면역진단법의 원리 및 특징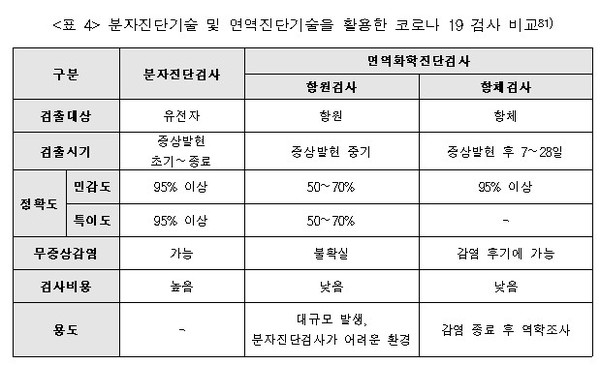 ▲ <표 4> 분자진단기술 및 면역진단기술을 활용한 코로나 19 검사 비교
▲ <표 4> 분자진단기술 및 면역진단기술을 활용한 코로나 19 검사 비교 ▲ <그림 5> 코로나 19 진단 방법
▲ <그림 5> 코로나 19 진단 방법