-
 K-ICT 3D프린팅 경북센터 개소
신근순 기자
2016-11-02
K-ICT 3D프린팅 경북센터 개소
신근순 기자
2016-11-02
-
 현대차·화물조합, 대형 상용차 안전 운행 ‘맞손’
배종인 기자
2016-11-01
현대차·화물조합, 대형 상용차 안전 운행 ‘맞손’
배종인 기자
2016-11-01
-
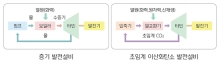 현대重-한전, 초임계 CO₂ 발전설비 기술 개발
편집국 기자
2016-11-01
현대重-한전, 초임계 CO₂ 발전설비 기술 개발
편집국 기자
2016-11-01
-
 3D프린팅 품질평가 가이드라인 설명회 개최
신근순 기자
2016-11-01
3D프린팅 품질평가 가이드라인 설명회 개최
신근순 기자
2016-11-01
-
 TPC, 스마트 협업로봇·3D프린팅 융합 스마트공장 솔루션 제시
신근순 기자
2016-10-31
TPC, 스마트 협업로봇·3D프린팅 융합 스마트공장 솔루션 제시
신근순 기자
2016-10-31
-
 현대·기아차, 커넥티드카 OS 개발 착수
배종인 기자
2016-10-31
현대·기아차, 커넥티드카 OS 개발 착수
배종인 기자
2016-10-31
-
 기아차, 3Q 매출 12조6,989억…전기比 12.1% ↓
배종인 기자
2016-10-28
기아차, 3Q 매출 12조6,989억…전기比 12.1% ↓
배종인 기자
2016-10-28
-
 세중정보기술, ‘착한가격’ 고정밀 3D프린터 중점 홍보
신근순 기자
2016-10-28
세중정보기술, ‘착한가격’ 고정밀 3D프린터 중점 홍보
신근순 기자
2016-10-28
-
 3D프린팅, 의료기술 발전 이끈다
신근순 기자
2016-10-28
3D프린팅, 의료기술 발전 이끈다
신근순 기자
2016-10-28
-
센트롤, 3D프린터 매출 100억 돌파
산업용 주물사 및 금속 금속 3D프린터 제조기업 센트롤(대표 최성환)이 3D프린팅 서비스 업체에 산업용 주물사 및 금속 3D프린터 공급을 통해 매출 100억원을 돌파했다.
센트롤은 최근 HYMS와 SLS(Selective Laser Sintering)방식 주물사 3D프린터 신제품 ‘SENTROL 3D SS400(G)’와 SLM(Selective Laser Melting) 방식 금속 3D프린터인 ‘SM350’ 등 총 10대를 공급하는 계약을 체결했다고 밝혔다. HYMS는 3D프린터를 제휴 대학에 렌탈해 실습 및 연구를 지원하고 센트롤과 함께 적층제조(AM) 공장을 본격적으로 구축하는 등 서비스분야에 본격 진출한다는 계획이다.
이로써 센트롤은 지난 10월11일 3D파인(대표이사 이영원)과 주물사 3D프린터 신제품 ‘SENTROL 3D SS400(G)’ 3대를 납품하는 등 올해만도 3D프린터 부문에서 100억원의 매출을 돌파하게 됐다. 센트롤은 지난해 CNC 및 3D프린터 사업부문에서 52억원의 매출을 기록한 바 있다.
이처럼 센트롤의 3D프린터가 시장에서 주목받는 것은 출력물 크기와 속도가 크게 개선된데 있다. SS400(G)는 400×400×400㎜크기로 출력이 가능하며 200~300μm 두께로 파우더를 적층해 최대 속도 7m/s의 레이저로 파우더를 소결할 수 있는데 이와 같은 속도는 지난해 9월 출시한 ‘SENTROL 3D SS600’ 대비 20배 이상 빨라진 속도다. 기존 3D프린터는 레이저가 X, Y테이블 방식으로 움직였다면, SS400(G)는 갈바노(Galvano) 방식의 거울 2개를 통해 레이저가 빠르게 움직이게 설계됐기 때문이다.
SM350은 최대 직경 350mm, 높이 330㎜ 크기의 제품을 만들 수 있는 대형 금속3D프린터다.
최성환 센트롤 대표는 “센트롤의 3D프린터는 완제품에 적용 가능한 복잡한 구조의 선박, 의료, 자동차, 항공기 부품 등을 직접 생산할 수 있어 기존 생산공정에 적용될 경우 시너지가 매우 크다”며 “출력 서비스 업체들과의 사업추진을 통해 어플리케이션 적용 분야를 찾고 새로운 장비와 서비스를 개발하는 선순환 구조를 구축함으로써 산업용 3D프린팅 시장 발전에 기여하겠다”고 밝혔다.
신근순 기자
2016-10-28
-
 산업부 3D프린팅 거점기관, 산업 경쟁력 강화 맞손
신근순 기자
2016-10-26
산업부 3D프린팅 거점기관, 산업 경쟁력 강화 맞손
신근순 기자
2016-10-26
-
 제네시스, ‘G80 스포츠’ 출시
배종인 기자
2016-10-26
제네시스, ‘G80 스포츠’ 출시
배종인 기자
2016-10-26
-
 현대차, 3Q 매출 22조837억…전기比 10.5% ↓
배종인 기자
2016-10-26
현대차, 3Q 매출 22조837억…전기比 10.5% ↓
배종인 기자
2016-10-26
-
 의료·車·생산공정 적용 3D프린팅 최신기술 한눈
신근순 기자
2016-10-25
의료·車·생산공정 적용 3D프린팅 최신기술 한눈
신근순 기자
2016-10-25
-
식약처, 3D 프린팅 의료기기 제품화 가이드라인 마련
식품의약품안전처(처장 손문기) 식품의약품안전평가원이 3D 프린터를 이용해 제조되는 의료기기가 신속하게 제품화될 수 있도록 지원에 나섰다.
식약처는 21일 정형용 임플란트와 치과용임플란트고정체에 대한 품목별 가이드라인을 마련해 제공한다고 밝혔다.
이번 가이드라인 개발은 지난 5월18일 박근혜 대통령 주재로 개최된 제5차 규제장관회의에서 신산업 규제혁신 발굴과제에 대한 후속조치로 국내 3D 프린팅 의료기기 제품화 연구개발을 선제적으로 지원하기 위한 것이다.
3D 프린팅 의료기기는 환자별로 맞춤형, 소량 생산이 가능한 제품으로, 제품 개발을 위해서는 품목 특성별 안전성과 성능 평가 방법, 시험규격 등의 세부 기준이 필요하다.
현재 국내에서 허가·신고된 3D 프린팅 의료기기는 광대뼈나 두개골 결손부위에 사용하는 정형용임플란트 및 이러한 임플란트 등의 수술시 수술부위를 표시·안내하기 위한 수술용 가이드 등 10개사, 18개 제품이다.
이번 가이드라인은 인공무릎관절, 인공엉덩이관절 등 정형용임플란트와 치과용임플란트고정체를 제조하는 업체들이 해당 제품에 대한 안전성과 성능을 확보할 수 있도록 시험항목, 시험방법 등 제품 개발 시 고려해야 할 사항을 안내하기 위해 마련했다.
주요 내용은 정형용임플란트와 치과용임플란트고정체 각각에 대한 △시험규격 설정 시 고려해야 할 사항 △생물학적 안전과 성능에 대한 시험항목 및 평가시험자료 △물리·화학적 특성에 대한 평가 항목, 시험방법 등이다.
이번 가이드라인 발간 이후에도 인공연골, 인공혈관·인공피부에 대한 가이드라인을 각각 마련하여 오는 11월 제공할 예정이다.
참고로 지난해 12월에는 3D 프린팅 의료기기 개발에 공통적으로 적용할 수 있는 ‘3D 프린터를 이용하여 제조되는 맞춤형 의료기기 허가심사 가이드라인’을 마련한 바 있다.
식약처는 앞으로도 3D 프린팅 의료기기에 대한 연구·개발부터 제품화에 이르기까지 선제적 지원을 통해 3D 프린팅 의료기기의 경쟁력을 확보하는 동시에 신속하게 제품화될 수 있도록 최선을 다하겠다고 밝혔다.
신근순 기자
2016-10-24
 K-ICT 3D프린팅 경북센터 개소
신근순 기자
2016-11-02
K-ICT 3D프린팅 경북센터 개소
신근순 기자
2016-11-02
 현대차·화물조합, 대형 상용차 안전 운행 ‘맞손’
배종인 기자
2016-11-01
현대차·화물조합, 대형 상용차 안전 운행 ‘맞손’
배종인 기자
2016-11-01
 현대重-한전, 초임계 CO₂ 발전설비 기술 개발
편집국 기자
2016-11-01
현대重-한전, 초임계 CO₂ 발전설비 기술 개발
편집국 기자
2016-11-01
 3D프린팅 품질평가 가이드라인 설명회 개최
신근순 기자
2016-11-01
3D프린팅 품질평가 가이드라인 설명회 개최
신근순 기자
2016-11-01
 TPC, 스마트 협업로봇·3D프린팅 융합 스마트공장 솔루션 제시
신근순 기자
2016-10-31
TPC, 스마트 협업로봇·3D프린팅 융합 스마트공장 솔루션 제시
신근순 기자
2016-10-31
 현대·기아차, 커넥티드카 OS 개발 착수
배종인 기자
2016-10-31
현대·기아차, 커넥티드카 OS 개발 착수
배종인 기자
2016-10-31
 기아차, 3Q 매출 12조6,989억…전기比 12.1% ↓
배종인 기자
2016-10-28
기아차, 3Q 매출 12조6,989억…전기比 12.1% ↓
배종인 기자
2016-10-28
 세중정보기술, ‘착한가격’ 고정밀 3D프린터 중점 홍보
신근순 기자
2016-10-28
세중정보기술, ‘착한가격’ 고정밀 3D프린터 중점 홍보
신근순 기자
2016-10-28
 3D프린팅, 의료기술 발전 이끈다
신근순 기자
2016-10-28
3D프린팅, 의료기술 발전 이끈다
신근순 기자
2016-10-28
 산업부 3D프린팅 거점기관, 산업 경쟁력 강화 맞손
신근순 기자
2016-10-26
산업부 3D프린팅 거점기관, 산업 경쟁력 강화 맞손
신근순 기자
2016-10-26
 제네시스, ‘G80 스포츠’ 출시
배종인 기자
2016-10-26
제네시스, ‘G80 스포츠’ 출시
배종인 기자
2016-10-26
 현대차, 3Q 매출 22조837억…전기比 10.5% ↓
배종인 기자
2016-10-26
현대차, 3Q 매출 22조837억…전기比 10.5% ↓
배종인 기자
2016-10-26
 의료·車·생산공정 적용 3D프린팅 최신기술 한눈
신근순 기자
2016-10-25
의료·車·생산공정 적용 3D프린팅 최신기술 한눈
신근순 기자
2016-10-25